益生菌大肠杆菌Nissle1917抗逆性能、猪肠上皮细胞黏附率及抑菌效果研究
导读
大肠杆菌Nissle 1917(EcN)(血清型为06:K5:H1)是一株被德国医生Alfred Nissle在一战期间发现并分离得到的无致病性的革兰氏阴性益生菌 。EcN的益生功能与其对肠道微生物的调控和肠道内细胞因子引起免疫反应存在关联。EcN通过调控抗菌肽的表达,增加免疫球蛋白A(IgA)和黏蛋白的分泌以及促进抗炎症免疫反应,在肠道中发挥重要的免疫功能。EcN也能通过上调紧密连接蛋白闭锁小带的表达以及促进紧密连接蛋白上调和再分布 ,对增强猪肠上皮细胞的紧密连接和提高黏膜屏障具有重要的作用。口服EcN能显著降低断奶仔腹猪泻率和竞争性阻碍沙门氏菌入侵,也能有效预防产毒素大肠杆菌的感染。由此可见,EcN对提高动物肠道免疫功能、保护肠道屏障具有重要的作用。益生菌在肠道内存活并黏附于肠道上皮细胞表面,是其发挥益生作用的前提和基础。因此,本试验旨在探明EcN的生长特性,耐酸、耐胆盐和耐热的性能,对猪肠上皮细胞黏附性能,以及对致病菌的抑菌效果,为EcN在动物生产中的应用提供参考意义。
1材料与方法
1.1 EcN生长曲线的测定和菌液制备
EcN菌株购自德国微生物菌种中心(编号为DSM 6601)。大肠杆菌K88菌株购自中国兽医药品监察。采用比浊法绘制EcN和大肠杆菌K88生长曲线,以培养时问(0~30 h)为横坐标,以对应的通过测定LB液体培养基培养菌液的600 nm吸光度值(OD600nm),OD600nm为纵坐标绘出EcN的生长曲线。采用LB液体培养基培养EcN和大肠杆菌K88菌液,用无菌磷酸盐缓冲液(PBS)将菌液调整浓度约为1.0x108CFU/mL,用于体外抗逆性能、猪肠上皮细胞黏附性能和抑菌效果检测。
1.2 IPEC-J2细胞的培养
猪空肠上皮细胞IPEC-J2细胞来自西南大学动物科技学院实验室的冻存细胞。将复苏细胞置于培养瓶中,加入5 mL DMEM 完全细胞培养液(含5%胎牛血清+1%双抗),置于37℃ 5% CO2培养箱中培养。待贴壁率达85%时,胰酶消化,调整浓度约为2.0x105个/mL,置于六孔培养板中继续培养,生长至单层后进行后续试验。
1.3 体外抗逆性能检测
1.3.1 耐酸和耐胆盐
取等体积EcN菌液分别置于pH 1.5、2.0和2.5的模拟胃液中,以pH 7.0模拟胃液为对照。再取等体积EcN菌液分别置于猪胆盐浓度为0、0.30% 、0.60%和0.90%的LB液体培养基中,每组3个重复。胃酸组和胆盐组置于37℃ 200 r/min恒温振荡器中分别培养3和24 h。处理后与处理前细菌总数比值的百分数为EcN存活率。
1.3.2 耐热
取4份9 mL灭菌生理盐水于试管中并预热至80℃ ,再分别加入1mL菌液,保温30、40、50和60 S后,迅速冷却,对不同保温时间组菌液按10倍梯度进行稀释,吸取100 μL最佳稀释浓度菌液均匀涂抹于LB固体培养基上,置于37℃ 培养箱中培养24 h后菌落计数,每组2个重复。调节水温至70、65℃ ,重复上述试验,用1.3.1中的计算方法计算EcN存活率。
1.4 IPEC-J2细胞黏附和抑菌试验
试验组取2 mL DMEM 不完全细胞培养液(不含双抗)和1 mL各时期(迟缓、对数、平稳和衰亡期)EcN菌液加入IPEC-J2细胞,以等体积无菌PBS替代EcN菌液作为对照组,每组重复3孔,置于37℃ 5% CO2培养2 h后,PBS漂洗5次,自然晾干,甲醇固定20 min,革兰氏染色,油镜下随机选取25个视野,拍照和计数100个细胞上黏附的EcN菌数,细胞黏附细菌数与加入细菌总数比值的百分数为EcN黏附率。
试验组取EcN菌液500 L与IPEC-J2细胞预先培养2 h后,再加入大肠杆菌K88菌液500 L和1 mL DMEM 不完全细胞培养液,以未加EcN的大肠杆菌K88菌液作为对照组。37℃ 5% CO2继续培养2 h后,PBS漂洗5次,裂解细胞并10倍梯度稀释裂解液,再均匀涂抹于选择性培养基紫红胆汁琼脂(VRBA)上,平板计数。每组重复4孔,取平均值。按以下公式计算EcN对致病菌的黏附抑制率:黏附抑制率(%)=100x(对照组一试验组)/对照组。
取100μL大肠杆菌K88菌液均匀涂抹于琼脂培养基上,于无菌超净台上室温晾干,再用牛津杯(直径为8 mm)进行打孔。取200 μL EcN菌液置于琼脂板上孔中,37℃培养24 h,测定抑菌圈直径,做3个重复,取平均值判定抑菌效果。
1.5 β-防御素-2和Toll样受体水平的检测
试验分为4组,试验组分别取l mL EcN(EcN组)、大肠杆菌K88(大肠杆菌K88组)及EcN+大肠杆菌K88混合液(体积比1:1,EcN+大肠杆菌K88组)置于IPEC-J2细胞已长至单层的六孔培养板中,另以等体积PBS作为对照组,再加入2 mL DMEM不完全细胞培养液培养3 h后,PBS漂洗5次,胰酶消化后转至1.5 mL离心管内,4℃12 000 r/min离心5 min,弃上清,再漂洗、离心弃上清,然后加入1 mL蛋白质裂解液,离心10 min取上清,采用蛋白质印迹(Western blot)法检测β-防御素-2和Toll样受体水平。
1.6 数据统计方法
采用Excel 2007软件进行数据整理,采用SAS 9.1.3软件的GLM 程序进行单因素方差分析,组间显著性分析采用Duncan氏法进行多重比较,结果以平均值和标准误(SEM)表示。
2结果与分析
2.1 EcN生长曲线
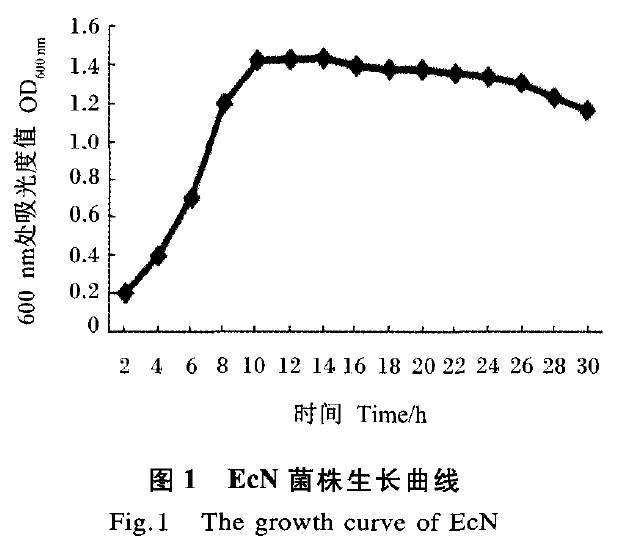
EcN生长曲线如图l所示。接种4 h后呈快速上升趋势,显示其进入对数生长阶段,培养10 h后逐渐进入稳定期,18 h后逐渐出现缓慢下降趋势,24 h后此趋势较明显,逐渐进入衰亡阶段。
2.2 EcN体外抗逆性能
EcN耐酸试验结果如表1所示。随模拟胃液pH的降低,EcN存活率显著下降(P<0.05)。当pH为2.5时,EcN存活率为30.26%,较对照组减少51.58%。pH为2.0和1.5时,EcN存活率分别为17.69% 、10.44% ,强酸性环境抑制EcN的生长。

EcN耐胆盐试验结果如表2所示。对照组存活率为84.95%,随胆盐浓度增加,EcN存活率显著下降(P<0.05)。胆盐浓度为0.30%时,其存活率迅速下降至27.34% 。当胆盐浓度从0.30%增加至0.90%时,存活率下降趋势较平缓。而胆盐浓度在0.60%和0.90%时,EcN存活率分别为21.03% 、15.21%。高胆盐环境会抑制EcN的生长。
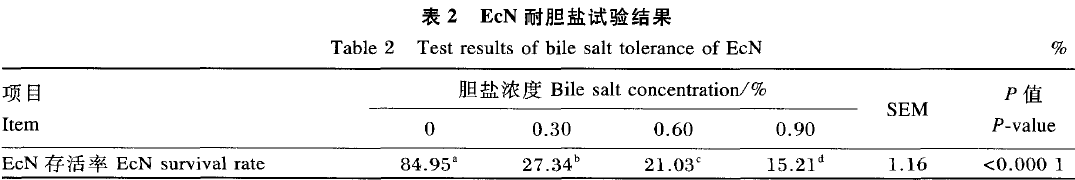
EcN温度耐受试验结果如图2所示。随水浴温度升高和保持时间增加,EcN存活率逐渐降低。不同温度保持30、40、50和60 S,在80℃ 时EcN存活率分别为15.86%、11.01%、5.29%和2.20%,除50和60 S差异不显著(P>0.05)外,其余时间点差异显著;在70℃ 时EcN存活率分别为59.03%、49.78%、43.61% 和30.40% ,各时间点差异显著(P<0.05);在65℃ 时EcN存活率分别为80.18% 、73.57% 、60.79% 和49.34% ,各时间点差异显著(P<0.05),存活率高于70和80℃。
2.3 EcN对IPEC-J2细胞的黏附作用
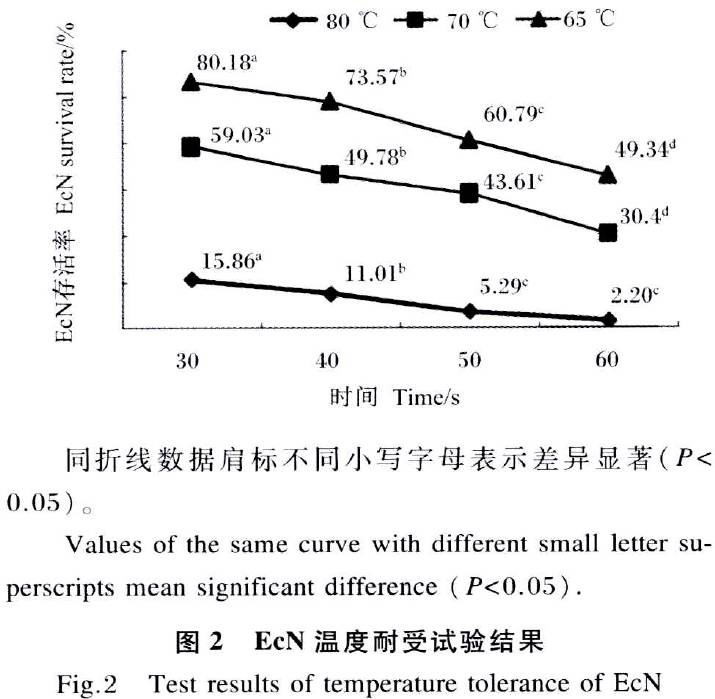
以测定的EcN生长曲线作参考,选用培养2、8、16和26 h的EcN,分别代表其迟缓期、对数期、稳定期和衰亡期4个生长阶段,进行后续试验。
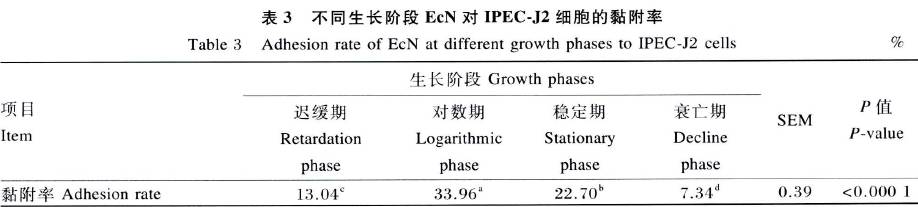
EcN对IPEC-J2细胞的黏附作用结果如图3和表3所示。不同生长阶段的EcN对IPEC-J2细胞黏附率差异显著(P<0.05)。以对数期EcN的黏附性能最佳,其每100个细胞黏附细菌数为3 056个,黏附率达33.96% ;其次是稳定期,每100个细胞黏附细菌数为2 043个,黏附率达22.70%;迟缓期和衰亡期的黏附性能分别居于第3和第4,每100个细胞黏附细菌数分别为1174、661个,黏附率分别达13.04% 、7.34%。
2.4 EcN对大肠杆菌K88的抑制作用
EcN对大肠杆菌K88的黏附抑制试验结果如表4所示。EcN对大肠杆菌K88的黏附抑制率达到87.84%。抑菌试验测得抑菌圈直径为4.73 mm。结果表明,EcN对大肠杆菌K88具有良好的抑制效果。

2.5 EcN对IPEC-J2细胞β-防御素-2和Toll样受体4水平的影响
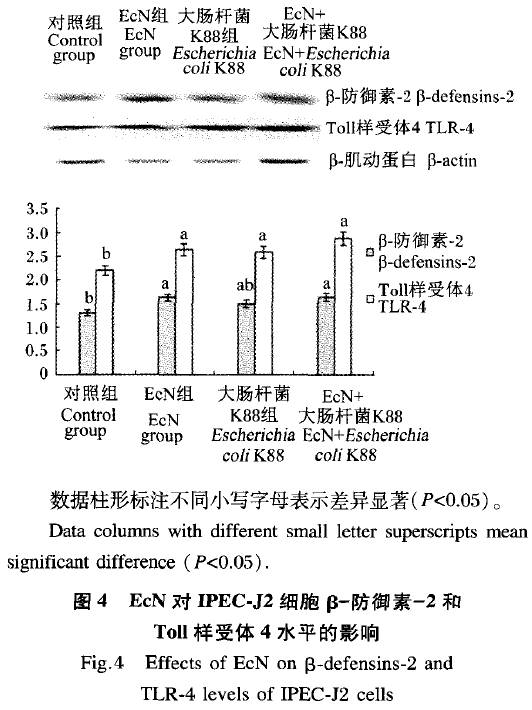
EcN对IPEC-J2细胞β-防御素-2和Toll佯受体4水平的影响如图4所示 对照组β-防御素-2水平显著低于EcN 组和EcN+人肠杆菌K88组(P<0.05),而 大肠杆菌K88组差异不显著(P>0.05),对照组Toll样受体4水平显著低于其他3组(P<0.05)。EcN组的β-防御素-2和Toll样受体4水平低于EcN+大肠杆菌K88组,但差异不显著(P>0.05)。此外,大肠杆菌K88组β-防御素-2和Toll样受体4水平略低于EcN组和EcN+大肠杆菌K88组,但差异均不显著(P>0.05)。
3讨 论
3.1 EcN的体外抗逆性能
研究表明,EcN拥有6种独特的铁摄取系统能产生铁螯合剂[肠菌素(enterobactin)、沙门菌螯铁蛋白(salmochelin)、耶尔森杆菌素(yersiniabactin)、产气菌素(aerobactin)、枸橼酸铁转运系统(ferric dicitrate transport system)和楚血红素转运位点(the chu heme transport locus)],摄取环境中的铁离子(Fe3+),用于代谢时能量的产生。而中性偏酸性条件更有利于EcN铁摄取系统产生4种铁螯合剂(enterobactin、salmochelin、aerobactin和yersiniabactin) 。由此推测,中性偏酸性环境更适宜EcN生存。虽然本试验EcN存活率随模拟胃液pH的降低而降低,但仍保持一定的存活,可见EcN对胃酸环境具有一定的耐受能力。猪胃内pH一般在2.0~3.5,饲粮变化会使胃酸pH在1.5~5.0波动,试验结果显示,在pH 2.5的模拟胃液中EcN也能存活,提示其能通过胃酸环境,进入肠道发挥益生作用。EcN除需要耐受胃酸环境外,还应耐受肠道中胆盐形成的高渗透压环境。猪肠道内胆盐含量一般在0.03%~0.50%内波动,而本试验显示高胆盐浓度(0.90%)环境下的EcN也依然能存活,可见EcN对肠道中的胆盐环境也具有一定的耐受能力。此外,EcN在高温环境中也能保持存活,表明其对温度具有一定的耐受能力。关于益生菌耐酸、耐胆盐、耐热性能的具体机制,Hatice等研究发现,乳酸菌能产生胞外多糖,能耐受较低的pH和高胆盐环境,Turpin等从分子水平发现益生菌乳酸片球菌(P.acidilactici)存在多种与耐酸、耐胆盐、耐热相关基因,如热休克蛋白(groEL)基因、D-丙氨酸转移酶(dltD)基因、clpL(一种ATP酶)基因和胆汁酸水解酶(bsh)基因等。因此,关于益生菌EcN耐受强酸高胆盐高温环境是否也存在上述相关或者其他潜在机制,还有待进一步研究。
3.2 EcN的黏附性能和抑菌性能
本试验对比研究了4个时期的EcN对IPEC-J2细胞黏附能力的大小,其黏附效果以对数期最佳。熊涛等发现Caco-2细胞黏附罗伊氏乳杆菌数随菌龄增大呈先增后减的趋势。这提示EcN能良好地黏附于IPEC-J2细胞表面可能与其生长阶段存在关联。菌毛是细菌附着于动物消化道黏膜上皮细胞表面的重要结构,EcN 自身基因组编码的FlA、FlC和卷曲菌毛能帮助其定植于IPEC-J2细胞上,并形成生物被膜抵御致病菌入侵。若缺乏FlC菌毛和鞭毛的表达,则会降低黏附性能和削弱对沙门氏菌入侵的抑制作用。也有文献报道,EcN通过FlC菌毛调控对细胞的黏附作用以及对致病菌的抑菌作用。EcN诱导IPEC-J2细胞分泌β-防御素-2和促进T细胞中Toll样受体4的表达,对抑制病原菌入侵和减轻肠道炎症具有重要作用,同时EcN诱导β-防御素-2的分泌可能与鞭毛存在关联;若EcN缺失编码Flc菌毛和鞭毛基因,黏附率分别降低99.9%和50.0%,同时降低抑菌能力。此外,EcN在IPEC-J2细胞上黏附和生长期间会形成鞭毛,其鞭毛长度和数量随培养时间的增加而增加 。由此可见,EcN良好地黏附于细胞表面发挥益生作用,Flc菌毛和鞭毛起着重要的作用。本试验关于EcN诱导IPEC-J2细胞对β-防御素-2和Toll样受体4的表达以及黏附作用机理只作了初步探究,而更深层次的黏附性能和抗菌机制仍需要进一步研究。
本试验中,用大肠杆菌K88感染预先与EcN培养一段时间的IPEC-J2细胞,发现EcN对大肠杆菌K88黏附抑制率达87.84%。Boudeau等 副先将IPEC-J2细胞与EcN预先培养一段时间后再加入致病性大肠杆菌进行培养和直接将2种菌同时加入IPEC-J2细胞进行培养,对比研究EcN对致病性大肠杆菌的抑制作用,结果发现前者的抑制率为97.2% ~99.9% ,后者为7.0% ~99.9%。Klete等 和Malchow等 也报道了预先将EcN与IPEC-J2细胞培养,能降低致病性大肠杆菌对细胞的感染机率,并影响致病菌对细胞的黏附和侵袭能力,而将EcN与沙门氏菌同时加入时,仅减少沙门氏菌入侵率为70%。推测EcN对细胞的黏附作用以及其生理功能的发挥可能存在时间效应。研究表明,增加EcN与细胞的预先培养时间有利于抑制病原菌的入侵,同时提高EcN的剂量,抑制效果更好。EcN预先培养和较高剂量使用也有利于提高肠道黏蛋白mRNA的表达水平。综上研究,EcN制剂在生产实践中尽早并高剂量使用,可能会更好的发挥益生作用。
本试验只对EcN相关机理只作了初步的探索,关于EcN黏附机理和对致病菌黏附抑制作用以及抗逆性能的研究,还需要从分子水平进行更深入的探索。
4结 论
① EcN对猪肠上皮细胞黏附效果以对数期最佳,并对致病菌大肠杆菌K88存在较强的抑制作用。
② EcN面对高酸、高胆盐环境也呈现一定的抗逆性能,有利于其在胃肠道内发挥生理作用。
- 上一篇:白酒糟发酵条件的探索和发酵对营养成分的改善 [2017-07-15]
- 下一篇:不同菌剂发酵中草药药渣对保存及适口性的影响 [2017-07-14]







